NAR | 孙力涛/朱莉团队揭示DNA模拟蛋白Ocr拮抗细菌免疫系统的分子机制
近年来,细菌耐药性已成为一个全球性问题。噬菌体(bacteriophages),即针对细菌的病毒,被视为一种天然的抗菌剂,能够特异性地裂解细菌。尽管如此,噬菌体疗法的广泛采用仍面临挑战,主要由于细菌拥有多种防御机制来抵抗噬菌体的侵袭。值得关注的是,噬菌体能够表达多种拮抗因子,例如Acr [1]、Acb [2]和Gad1 [3]等,以克服这些防御机制。这些拮抗因子的发现和研究不仅加强了我们对噬菌体与细菌之间复杂相互作用的认识,而且为噬菌体疗法的推广应用提供了支持。
2024年7月11日,中山大学公共卫生学院(深圳)孙力涛团队和兰州大学生命科学院朱莉团队合作,在Nucleic Acids Research 期刊发表了题为:Ocr-mediated suppression of BrxX unveils a phage counter-defense mechanism的研究成果。该研究深入探讨了一种细菌防御噬菌体感染的BREX系统中的核心蛋白BrxX,揭示了BrxX如何识别并甲基化特定的DNA序列,以及其在BREX系统中可能的调控作用。进一步的分析显示,T7噬菌体产生的DNA模拟蛋白Ocr能够与BrxX形成稳定的四聚体复合物(图1),有效抑制BrxX的甲基转移酶活性。研究还发现,Ocr与BrxX的相互作用在不同细菌间具有保守性。这些发现不仅为理解噬菌体如何中和细菌的防御机制提供了新的视角,也可能对开发新型噬菌体疗法以克服抗生素抗性具有重要的启示作用。

在本研究中,研究团队首先对BREX系统中的BrxX蛋白进行了体外甲基转移酶活性测试。结果表明,尽管BrxX与DNA结合不具有序列特异性,但它能够特异性地催化5′-GGTAAG-3′基序。此外,酶动力学数据揭示了BrxX对其底物S-腺苷甲硫氨酸(SAM)的Km值较高,暗示BrxX与SAM之间的结合亲和力较弱,表明BrxX的活性可能在细胞内受到SAM浓度的调控。有意思的是最近的一项研究证实了这个猜想,T3噬菌体的0.3基因编码的SAMase能够通过调节宿主细胞内的SAM水平来抑制BREX防御机制[4]。
为了探究噬菌体的Ocr蛋白是否能够抑制细菌BrxX的甲基转移酶活性,研究团队通过EMSA等实验发现Ocr能够阻断BrxX与底物DNA的结合。体外酶活性实验也证实了Ocr能够有效抑制BrxX的甲基转移酶活性。
 Ocr2–BrxX2四聚体的电镜结构及相互作用分析
Ocr2–BrxX2四聚体的电镜结构及相互作用分析
为了深入理解Ocr蛋白的作用机制,研究团队利用冷冻电镜技术解析了Ocr与大肠杆菌中BrxX蛋白形成的复合体结构。研究发现Ocr和BrxX分子以2 : 2 模式形成四聚体复合物。在Ocr2-BrxX2复合体结构中,整个Ocr 二聚体嵌入到DNA结合缝隙中,占据了BrxX 的DNA结合通道(图1B)。Ocr二聚体由两个BrxX 分子的DNA结合区域(TRD)和C 末端包裹,Ocr的N 末端延伸到BrxX 的TRD的间隙(图1C)。由于BrxX 的DNA 结合缝隙由Ocr 填充,稳定了灵活的TRD 区域引起的N 端和C 端的构象摆动。从电荷分布分析来看,Ocr作为一种DNA模拟蛋白,其表面带有负电荷的残基与BrxX的TRD裂隙和C末端的正电荷表面形成了完美的互补(图1D和1E)。进一步的详细分析显示,Ocr与BrxX之间存在多种非共价相互作用,这些相互作用有助于它们之间形成稳定的复合物(图1F)。通过序列和结构的比较分析,研究团队还发现Ocr与BrxX的相互作用界面在不同细菌中的BrxX分子中具有高度的保守性。这一发现表明Ocr能够以一种通用的结合模式广泛抑制BREX系统的防御功能(图2)。
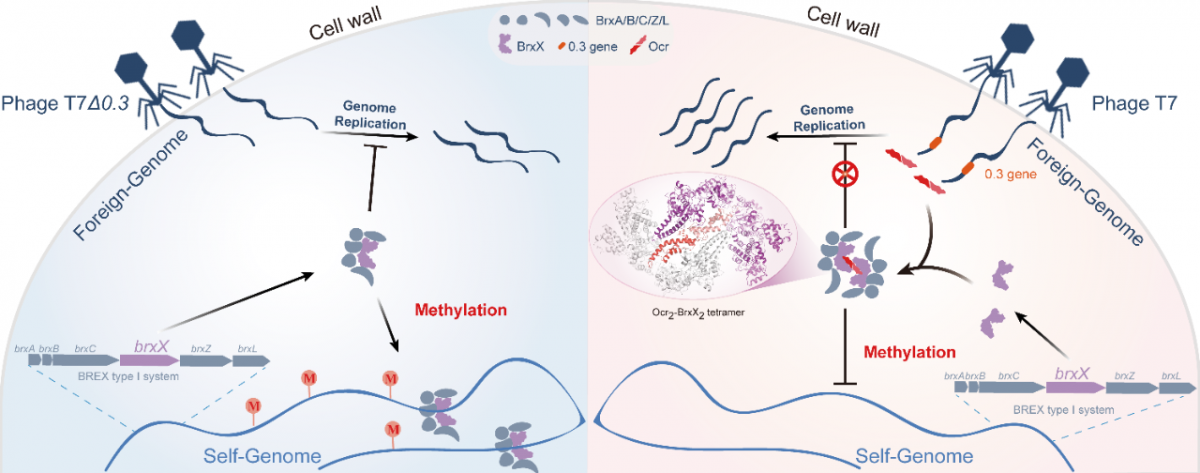 Ocr抑制BREX防御系统分子机制模式图
Ocr抑制BREX防御系统分子机制模式图
文章链接:https://doi.org/10.1093/nar/gkae608
原文链接:https://mp.weixin.qq.com/s/GNrqMYyX7mCimlzS-8w6yg
初审:何嘉敏
审核:杨崇广
审定发布:汪宗芳



